Hoe worden referentiewaarden vastgesteld en hoe zouden ze gebruikt moeten worden?
Aan welke voorwaarden moet een referentiewaarde voldoen, wil men deze kunnen gebruiken als diagnostisch criterium? Om deze vraag te kunnen beantwoorden is het van belang te weten hoe een beslisgrens zou moeten worden vastgesteld, wil die valide zijn. Onderstaande uitleg is een bewerking van teksten uit het boek “Interpretatie van Medisch Laboratoriumonderzoek” door Dr. Raymakers et.al.1 Het voorbeeld is bewerkt om de problematiek rond de vitamine B12 referentiewaarde inzichtelijk te maken.
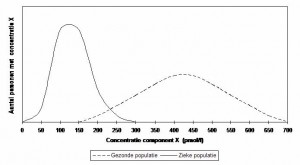
Wetenschappelijk onderzoek2 heeft uigewezen dat bij patiënten die een B12 opnamestoornis hebben, de eerste tekenen van een B12 tekort op celniveau soms al op treden bij serum B12 concentraties tot aan wel 300 pmol/l. Deze grenswaarde wordt in verschillende diagnostische protocollen geadviseerd3,4,5. De getallen op de x-as zijn zo gekozen dat zij de range waarden aangeven die bij personen met de ziekte (een vitamine B12 opnamestoornis) en gezonde personen voorkomen. De frequentieverdeling is een aanname. Wanneer men een grenswaarde vast wil stellen is het van belang te weten welke laboratoriumuitslagen gevonden worden bij personen die de ziekte hebben die men wil aantonen en welke uitslagen worden gevonden bij gezonde mensen. Dit levert bijvoorbeeld de volgende curven op:
In de grafiek is te zien dat de waarden voor gezonde personen en personen met de ziekte, elkaar overlappen. Dit is een veel voorkomend verschijnsel. Dat levert problemen op wanneer men de labuitslag wil gebruiken om tot een eenduidige uitspraak te komen over het wel of niet ziek zijn van de patiënt. Welke grenswaarde moet men dan kiezen? Bij het vaststellen van grenswaarden worden twee begrippen gehanteerd die de toepasbaarheid van de grenswaarde weergeven1,7 : diagnostische sensitiviteit en diagnostische specificiteit.
Diagnostische sensitiviteit: Dit betreft het percentage van de personen met de ziekte, dat een positieve testuitslag geeft en dat dus met de test wordt aangetoond. Wanneer men in het bovenstaande voorbeeld de grenswaarde bij 300 pmol/l kiest, dan kan men er zeker van zijn dat alle mensen die de ziekte hebben, ook door de test als positief worden aangemerkt. De diagnostische sensitiviteit is dan 100%. Nadeel hierbij is dat een aantal mensen met ziekteverschijnselen afkomstig van een andere ziekte, een fout positieve uitslag geven.
Diagnostische specificiteit: Dit is het percentage van de gezonde personen, dat een terecht negatieve testuitslag geeft. Wanneer men de grenswaarde bij 150 pmol/l kiest, kan men met zekerheid zeggen dat er geen vals positieve testuitslagen zijn. Men zegt dan: de test is 100% specifiek. Nadeel hierbij is dat alle zieke mensen met labuitslagen tussen de 150 pmol/l en 300 pmol/l door de test gezond worden verklaard en dus niet behandeld. Dit zijn de fout negatieve uitslagen. De diagnostische sensitiviteit is laag. Uit dit voorbeeld volgt dat een hoge sensitiviteit en een hoge specificiteit niet samen gaan voor deze bepaling. Tevens zijn zowel de sensitiviteit als de specificiteit afhankelijk van de gekozen grenswaarde. Op beide grenswaarden valt het een en ander af te dingen.
Hoe moeten we dan kiezen en welke argumenten wegen het zwaarst? De volgende uitgangspunten zijn binnen de klinische chemie algemeen aanvaard, als het gaat om het vaststellen van grenswaarden als diagnostisch criterium.
De bruikbaarheid van de B12 serumwaarde als diagnostisch criterium. De huidige grenswaarde is 150 pmol/l. Dit is de ondergrens van het normaalwaardegebied. Men heeft op deze wijze een zeer specifieke bepaling. Uit bovenstaande voorbeeld volgt dat men deze waarde kan gebruiken om met zekerheid aan te tonen dat iemand wiens B12 serum waarde lager dan 150 pmol/l is, een B12 tekort heeft. Dat is dan ook het enige juiste gebruik van deze waarde. Vitamine B12 deficiëntie gaat gepaard met de ontwikkeling van de Gecombineerde Strengziekte. Het beloop van deze neurologische ziekte is, wanneer onbehandeld, binnen vijf jaar fataal . Wanneer tijdig behandeld is de neurologische schade nog reversibel. Ernstige blijvende neurologische schade is het gevolg als de behandeling te laat wordt gestart9,10 . De behandeling met injecties is goedkoop en vitamine B12 is zelfs in hoge dosering niet toxisch3.
Volgens de algemeen aanvaarde uitgangspunten, verdient een ernstige ziekte die goed behandeld kan worden een heel sensitieve test en is een hoge specificiteit van ondergeschikt belang. Men wil immers bij zo veel mogelijk patiënten de ziekte tijdig onderkennen. Bij een 100% sensitiviteit hoort in dit geval een grenswaarde van 300 pmol/l. Het nadeel hiervan, dat een patiënt ten onrechte als B12 deficiënt wordt bestempeld en met onschuldige en goedkope injecties wordt behandeld, weegt niet op tegen de nadelen van een te laat gestelde diagnose voor patiënt en maatschappij: blijvende neurologische schade met invaliditeit en arbeidongeschiktheid tot gevolg. Citaat uit het Diagnostisch Kompas7 :
Aanvullend laboratoriumonderzoek met een meer specifieke bepaling (bijv. de bepaling van methylmalonzuur, de bepalingen van antistoffen tegen Intrinsic Factor en antistoffen tegen pariëtale cellen) kan dus gebruikt worden met het doel de diagnose B12 deficiëntie te bevestigen. Instrumenten om een B12 tekort bij een twijfelachtige B12 serum waarde uit te sluiten, staan ons tot dusverre nog niet ter beschikking. Helaas heeft geen van de laboratoriumbepalingen die in gebruik zijn bij de B12 diagnose, een diagnostische sensitiviteit van 100%. Er bestaat voor de bepaling van B12 gebrek geen “gouden standaard”. Vanwege de ernst van de ziekte wordt tegenwoordig wel geadviseerd de behandeling met injecties te starten ook als de diagnose niet onomstotelijk bevestigd is11.
Bronnen
1. Dr. J.A. Raymakers, Dr. H.J.H. Kreutzer, Dr. P.M. Schneeberger, “Interpretatie van Medisch Laboratoriumonderzoek”, Bohn Stafleu van Loghum, Houten, 2005, p. 16-20.
2. Lindenbaum, J., Savage, D.G., Stabler, S.P., Allen, R.H. Diagnosis of Cobalamin Deficiency: II. Relative Sensitivities of Serum Cobalamin, Methylmalonic Acid, and Total Homocysteine Concentrations. American Journal of Hematology. 1990, 34, 99-107. 3. Dharmarajan, T.S., Norkus, E.P. Approaches to vitamin b12 deficiency. Postgraduate Medicin. 2001, 110, 99-105
4. Oh, R.C., Brown, D.L. Vitamin B12 deficiency. American Family Physician 2003, 67, 979-986.
5. Snow, C.F. Laboratory Diagnosis of Vitamin B12 and Folate Deficiency. Arch. Int. Med. 1999, 159, 1289-1298.
6. SAN(Samenwerkende Artsen Laboratoria Nederland) Memoboek: http://memoboek.dynapaper.nl/84/vitamine-b12.html.
7. Diagnostisch Kompas, CVZ, 2003, p. 22-24.
8. Kumar, P., Clark, M. ed., “Clinical Medicine”, 6th Ed, Elsevier/Saunders, London, 2005, p. 1263.
9. Brust, J.C.M.,ed, “Current Diagnosis and Treatment in Neurology”, McGraw-Hill, New York, 2007, p.271.
10. Mumenthaler, M. en Mattle, H., “Neurology”, 4th. Ed, Georg Thieme Verlag, Stuttgard, 2004, p. 442.
11. Solomon, L. R. Disorders of cobalamin (vitamin B12) metabolism: emerging concepts in pathophysiology, diagnosis and treatment. Blood Rev. 2007; 3:113-30; Epub 2006 Jul 11.